生物物理實驗室
(Laboratory for measurement in Biological Physics,
LAMB)
簡介:
物理學的發展以牛頓的古典力學及近代的量子力學為基礎,至今已獲得相當成果。其中影響最大的例子莫過於探討固態物理及量子力學,其研發出的積體電路創造了人類數位科技的文明。生物體是一個由多種生物分子構成的複雜系統,由於生命系統的高度複雜,生醫科技的研究將不再是生物學者、專家所能獨立推動,而必須結合物理、光學、機電領域的人才共同研發。要了解生物世界,必須研究生物在不同尺度的各個層次,諸如生物分子,胞器,細胞,組織,器官,生物體,生物群落等,而其中所涉及的物理過程揭示生物物理的研究範疇。值此後基因時代,使用物理學來探討生物體這個複雜系統,其成果應可期待,是物理學繼續發展的契機,也勢必成為物理研究的主流之一。
我們竭誠歡迎物理、光電或生物等科學或工程背景的博後及博、碩士生攜手參與、共同奮鬥。
我們的專長主要是在奈米生醫、生醫感測及生醫影像之應用研究。近五年來具體之研究主題如下:

利用自組裝雷射光鉗系統探討細胞黏度的研究
自1970年Arthur
Ashkin研究出利用雷射光為基礎的捕捉技術後,雷射光鉗(optical tweezers)便開始不斷創新發展進步。近年來,雷射光鉗為一種研究細胞體內與體外機械特性的技術工具,例如量測細胞質的黏彈性(viscoelasticity)及細胞裡外的複數形式的剪力模數(complex
shear modulus)等。本研究先行架設雷射光鉗系統,以一道雷射光分光為一捕捉光和一偵測光來達到偵測微球於介質中布朗運動的目的。本研究欲改善之前量測黏度相關研究中利用捕捉推測大小及形狀的胞器而使黏度等物理特性為推算值的部份,利用抓取送入免疫細胞RAW
264.7內直徑約2 μm的聚苯乙烯微球(polystyrene
bead)以直接量測免疫細胞RAW 264.7內的黏度並使用Selhuber-Unkel等人所使用的表示方法來呈現介質的黏度,接著加入抗癌藥物–紫杉醇(Paclitaxel)觀測免疫細胞因藥物造成黏度的改變。
進行研究之前,需先行量測自組裝光鉗系統的參數,例如光鉗的彈性係數及光四象限二極體的電壓–位移轉換因子–β等。本研究利用固定微球方法(stuck
bead method)以及兩種以能量頻譜為基礎來計算的方法求得β值,而光鉗鋼性係數的量測分別使用能量頻譜(power
spectral density)、能量均分定理(equipartition)及波茲曼分佈(Boltzman
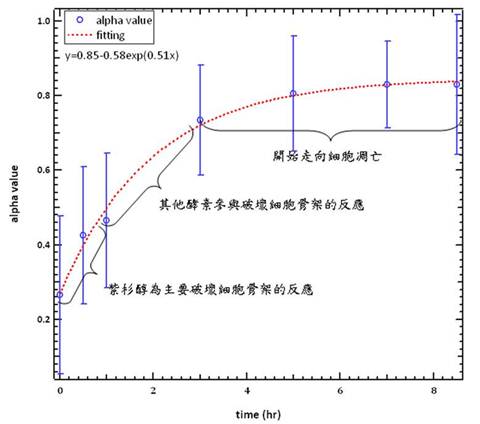
distribution)來分析。了解此系統的物理參數後,隨後利用此系統針對已知液體的黏度做量測,結果發現相符合。隨後進行量測正常免疫細胞的黏度並與相關文獻比較,再加入紫杉醇與細胞共培養,量測細胞在藥物累積下的黏度變化。本研究發現當藥物累積,免疫細胞的黏度會越來越小,一開始3小時間黏度會大幅度的改變到最後趨於平穩的狀態。除此之外,本研究藉由細胞的型態以及共軛焦掃描顯微鏡的判斷,推測透過本實驗亦可觀測到細胞走向細胞凋亡的過程。本研究推測在200
nM濃度下的紫杉醇,加藥後0.5-1小時的時間應為藥物作用於細胞的時間,而1-3小時開始有細胞內溶解酵素的參與分解細胞骨架,3-8.5小時後,免疫細胞走向細胞凋亡。本研究希冀提供未來藉由量測細胞的黏度來看藥物對於細胞是否走向細胞凋亡的方法。
高解析雷射光鉗--單分子操控
在現今的生化研究上,除了以傳統的方法觀察眾多分子間的平均行為外,如何觀察到單一分子的空間結構及時間行為,將會是另一重要課題。因此,希望藉由光鉗技術的引進,以非接觸的方法捕獲直徑大小約數十微米至數百奈米的細胞、分子,以觀察其單一分子的特性。雷射光鉗的基本原理是以高度聚焦單束雷射光照射於欲捕獲之物體上,使光子以極大立體角射入微粒,再利用光子動量轉移所產生的作用力來操控微米級的小分子,如細胞、胞器或是塑膠微粒等等。Laser
tweezers應用於生化研究上最大的優點在於其非接觸性及非侵入性,再加以選擇生物吸收係數小的雷射波段,則對其捕獲的生物非子幾乎不會造成傷害,因此可以用其精準的觀察單一分子的行為。我們的實驗團隊則以高解析度雷射光鉗系統作為發展方向。我們目前已建立聲光調變(AOD)掃描之雙光鉗系統,其光路圖、實體圖及成果如下兩圖所示。目前我們已利用此系統抓住DNA片段之兩端,其力與DNA拉伸距離如下右圖所示,另外我們也完成了一系列在雙股DNA上嵌入不同濃度之TC

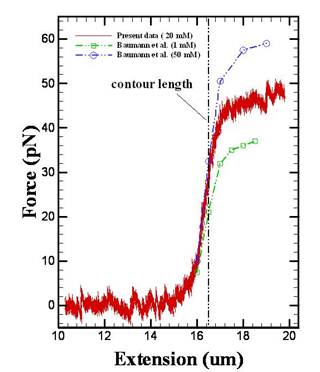
lDNA受力之拉伸曲線
表面電漿共振距今已發展將近一個世紀(Beginner:Wood,1900),但是在近30年左右才開始發展為生物感測器,而傳統方式是以強度量測的方式來得到共振角的變化,但是傳統方法因為容易受到光源的直流漂移(DC
shift)與儀器本身放大迴路的影響而導致強度量測的靈敏度下降,是故我們的表面電漿共振架構將以共光程的方式並且利用外差干涉的技術來量測表面電漿共振發生時TE與TM的相對相位改變。經由我們的改良,我們的解析度可到10-7RI,此與國外之最佳解析度相當。現在正在做生物感測器的相關研究,我們最低偵測極限可達到數個ng/ml。系統示意圖及系統完成之實體圖亦如下:
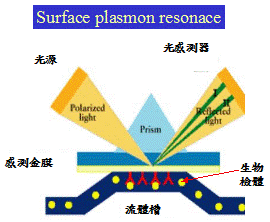

統示意圖
系統完成之實體圖
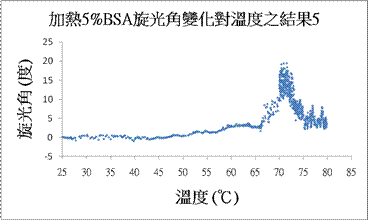
生物分子之高解析度旋光研究
自然界中存在許多具有特殊構型的分子,其分子化學結構具對掌性(chiral),即其分子無法經空間的旋轉與同種分子重疊。此種分子與光產生交互作用後使光的偏振態發生旋轉,我們稱此種分子為光學異構物(enantiomers)。而一道線性偏振光入射於光學異構物的物質後將產生偏振態的旋轉,此種物質稱具光學活性(optical
activity),而此種現象稱旋光現象(optical
rotation),旋轉的角度稱旋光角。自然界中有許多物質具光學活性,如有機化合物中的特定構型蛋白質以及葡萄糖、蔗糖、乳酸等,或無機化合物中的石英。自從發現了旋光現象,科學家就常利用此性質檢測液態物質的濃度或固態物質的分子結構。
目前有研究團隊利用旋光現象來對人體作非侵入式的血糖量測。我們則利用旋光現象來對蛋白質作即時性的觀察。由於蛋白質的二級結構與旋光角有關,故蛋白質因外在因素作用下改變而導致構型的摺疊(folding)或展開(unfolding),將會改變其二級結構。如α螺旋(α-helix)、β(β-sheet)平板或隨機的圈(random coil)之比列,繼而造成旋光角的變化,故我們即可由旋光角的變化間接觀察蛋白質構型即時的變化。
在我們的系統中,我們採用了共光程外差干涉儀來作為基本架構,配合使用一相位可調式波片來達成相位靈敏偵測的目的,使得系統擁有濃度的辨別能力約